מהו Temozolomide Hospira?
Temozolomide Hospira היא תרופה המכילה את החומר הפעיל temozolomide. ניתן להשיג כמוסות (לבן וירוק: 5 מ"ג; לבן וצהוב: 20 מ"ג; לבן וורוד: 100 מ"ג; לבן וכחול: 140 מ"ג; לבן וחום: 180 מ"ג; לבן: 250 מ"ג).
Temozolomide Hospira היא 'תרופה גנרית', כלומר טמוזולומיד הוספירה דומה ל'תרופה הפניה 'שכבר מורשית באיחוד האירופי (EU) בשם Temodal.
למה משמש Temozolomide Hospira?
Temozolomide Hospira היא תרופה נגד סרטן. הוא מיועד לטיפול בגליומות ממאירות (גידולים במוח) בקבוצות המטופלים הבאות:
מבוגרים שאובחנו לאחרונה עם גליובלסטומה מולטיפורמה (סוג גידול אגרסיבי במיוחד). Temozolomide Hospira משמש תחילה עם הקרנות, ואז לבד;
מבוגרים וילדים מגיל שלוש עם גליומה ממאירה כגון גליובלסטומה מולטיפורמה או אסטרוציטומה אנפלסטית, כאשר הגידול הופיע שוב או החמיר לאחר טיפול סטנדרטי. Temozolomide Hospira משמש לבד בחולים אלה.
את התרופה ניתן להשיג רק במרשם רופא.
כיצד משתמשים ב- Temozolomide Hospira?
טיפול ב- Temozolomide Hospira צריך להירשם על ידי רופא המנוסה בטיפול בגידולים במוח.
המינון של Temozolomide Hospira, הניתן פעם ביום, תלוי בשטח הגוף (מחושב לפי גובה ומשקל המטופל) ונע בין 75 ל 200 מ"ג למ"ר פעם ביום. הם תלויים בסוג הסרטן המטופל, אם המטופל טופל בעבר, האם Temozolomide Hospira משמש לבד או עם טיפולים אחרים, ותגובת המטופל לטיפול. יש לתת Temozolomide Hospira בין הארוחות.
לפני מתן Temozolomide Hospira, החולים עשויים להזדקק גם לתרופה המונעת הקאות. יש להשתמש בזהירות ב- Temozolomide Hospira בחולים עם בעיות בכבד או בכליות קשות.
למידע מלא, עיין בסיכום מאפייני המוצר (כלול גם ב- EPAR).
כיצד פועל Temozolomide Hospira?
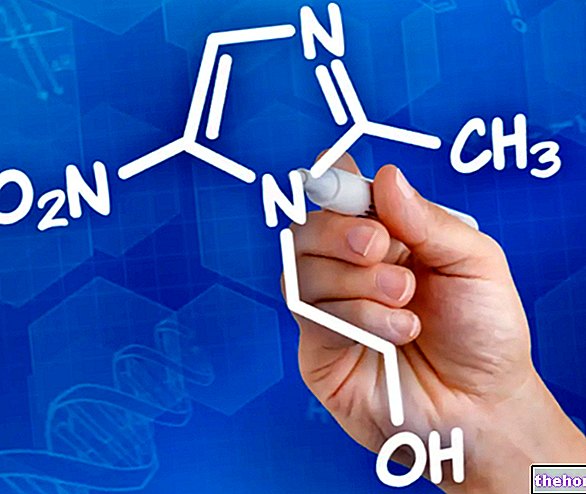
החומר הפעיל ב- Temozolomide Hospira, temozolomide, שייך לקבוצה של תרופות נגד סרטן הנקראות אלקילציה. בגוף, temozolomide הופך למתחם אחר הנקרא MTIC. MTIC נקשר ל- DNA של התאים במהלך שלב הרבייה, ובכך חוסם את חלוקת התאים. כתוצאה מכך, תאים סרטניים אינם יכולים להתרבות וצמיחת הגידול מואטת.
כיצד נחקר Temozolomide Hospira?
מאחר ש- Temozolomide Hospira היא תרופה גנרית, המחקרים הוגבלו לראיות המראים כי התרופה מקבילה ביולוגית לתרופת הייחוס, Temodal. שתי תרופות מקבילות ביו כאשר הן מייצרות את אותן רמות של החומר הפעיל בגוף.
מהם היתרונות והסיכונים של Temozolomide Hospira?
מכיוון שטמוזולומיד הוספירה היא תרופה גנרית והיא מקבילה ביולוגית לתרופת הייחוס, ההנחה והיתרונות של התרופה הם זהים לתרופת ההתייחסות.
מדוע אושרה טמוזולומיד הוספירה?
הוועדה לתרופות לשימוש אנושי (CHMP) הגיעה למסקנה כי על סמך דרישות החקיקה של האיחוד האירופי, הוכח כי טמוזולומיד הוספירה היא בעלת איכות דומה וכינה ביו -שוויונית לטמדול. לפיכך, CHMP סבורה כי כמו במקרה של טמודל, היתרונות עולים על הסיכונים שזוהו. לפיכך המליצה הוועדה על מתן אישור שיווק ל- Temozolomide Hospira.
מידע נוסף על Temozolomide Hospira
ב- 15 במרץ 2010, הנציבות האירופית העניקה ל- Hospira UK Ltd "אישור שיווק" עבור Temozolomide Hospira, תקף ברחבי האיחוד האירופי.
אישור השיווק תקף לחמש שנים וניתן לחדש אותו לאחר תקופה זו.
לגרסה המלאה של EPAR Temozolomide Hospira לחץ כאן.
למידע נוסף על טיפול ב- Temozolomide Hospira, אנא קרא את עלון החבילה (כלול ב- EPAR).
ניתן למצוא את גרסת ה- EPAR המלאה של תרופת הייחוס גם באתר הסוכנות.
עדכון אחרון של סיכום זה: 03/2010.
המידע על Temozolomide Hospira המתפרסם בדף זה עשוי להיות מיושן או לא שלם. לקבלת שימוש נכון במידע זה, עיין בדף כתב ויתור ומידע שימושי.