הגדרה של אוסמוזה
אוסמוזה היא מעבר ספונטני של ממס (שבמערכות ביולוגיות הוא בדרך כלל מים), מהתמיסה שבה המומסים מדוללים יותר לזה שבו הם מרוכזים יותר; תנועה זו - המתרחשת דרך קרום חדיר למחצה - נמשכת עד להגעת למצב שיווי משקל, בו שני הפתרונות צוברים ושומרים על אותו ריכוז.
דוגמא מעשית

כדי להבהיר טוב יותר את מושג האוסמוזה, בואו נדמיין שיש לנו מיכל המחולק לשני תאים בעלי נפח שווה (A ו- B) על ידי קרום חדיר למחצה (כלומר חדיר רק לממס - במקרה זה מים - ולא למים תא A. יש תמיסה מימית שבה מומסה כף גלוקוז, בעוד שבחלק ב 'יש לנו תמיסה מימית בנפח שווה שבה נמסו שלוש כפות גלוקוז (לכן הוא מרוכז יותר). ההבדל יוצר שיפוע ריכוז לגלוקוז בצידי הממברנה, ומכיוון שסוכר זה אינו יכול לחצות אותו, מגיעים לשיווי משקל עם מעבר מים מתא A (בו הגלוקוז מדולל יותר) לכיוון תא B (בו הוא שופע יותר) ). אם אתה מעדיף, אפשר גם לומר שהמים עוברים באוסמוזה מהתמיסה שבה הם מרוכזים יותר (A) לזה שבו הם פחות מרוכזים (B).
בעקבות זרימה זו, מפלס המים ב- B עולה ויורד ב- A, ויוצר הבדל ברמה מסוימת בין השניים. תופעה זו מסתיימת כאשר שני הפתרונות מגיעים לאותו ריכוז, ואז שומרים אותו קבוע.
פתרונות היפוטוניים, איזוטוניים והיפרטוניים
אם לוקחים שני פתרונות בריכוז טוחני שונה (מספר חלקיקים שונים המומסים בהם), הפתרון בעל הריכוז הטוחני הנמוך ביותר מוגדר היפוטוני והריכוז יותר היפרטוני. שני פתרונות הם במקום זאת איזוטוניים (או אקווימולאריים) כאשר יש להם אותו ריכוז.
בדוגמה שזה עתה נוצר, פתרון B הוא היפרטוני (לכן הוא מכיל יותר מומסים) מהאחר (המוגדר כיפוטוני); לכן, בתנאים רגילים, הממס עובר באוסמוזה מהפתרון ההיפוטוני לפתרון ההיפרטוני. דיברנו על תנאים סטנדרטיים מכיוון שמשחק עם חוקי הפיזיקה אפשר להפוך את עצם מושג האוסמוזה ולהעדיף את מעבר הממס מהריכוז המדולל ביותר למרוכז ביותר (אוסמוזה הפוכה).
לחץ אוסמוטי ואוסמוזה הפוכה
כפי שהתבטא עד כה, הזרימה נטו של הממס - שנוצר על ידי אוסמוזה - נמשכת עד ששני הפתרונות הגיעו לאותו ריכוז. ובכן, ניתן לנטרל, לעצור או אפילו להפוך את התנועה הזו על ידי הפעלת לחץ על התא בעל הריכוז הגבוה ביותר.

בדוגמה הקודמת מספיק למקם בוכנה בתא B (שאנו זוכרים שיש לו ריכוז גבוה יותר), ולדחוף אותו כלפי מטה בכוח מסוים, כדי להעדיף מעבר מים לכיוון A; במקרה זה אנו מדברים על הפוך סְפִיגָה.
לחץ אוסמוטי הוא הלחץ המתנגד בדיוק למעבר הממס דרך הקרום החצי -חדיר; כתוצאה מכך זהו הלחץ הדרוש כדי למנוע אוסמוזה.
לפי מה שנאמר עד כה, לשני פתרונות איזוטוניים יש אותו לחץ אוסמוטי; יש להדגיש, אם כן, כי הלחץ האוסמוטי תלוי אך ורק במספר החלקיקים הקיימים בתמיסה ולא בטבעם.
אוסמוזה וגוף האדם
ממברנות הפלזמה המקיפות את תאי גוף האדם, הן למעשה ממברנות חדירות למחצה, המאפשרות מעבר ישיר, באמצעות אוסמוזה, של מולקולות קטנות (כגון מים ואוריאה), אך לא של בעלות משקל מולקולרי גדול יותר ( כגון חלבונים, חומצות אמינו וסוכרים). מאזן אוסמוטי בנוזלי הגוף הוא אפוא חיוני בכדי להבטיח לתאים סביבה אופטימלית לחיות בה.
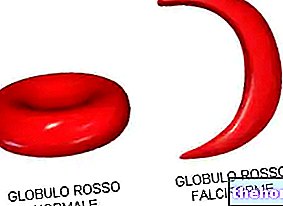
אם ניקח תא כמו כדור דם אדום ונטבול אותו בתמיסה היפוטונית, הדבר - על ידי אוסמוזה - עובר נפיחות (הנגרמת מכניסת מים), מה שאפילו יכול לגרום לו להתפוצץ. להיפך, אם הוא שקוע בתוך פתרון היפרטוני התא שהוא עובר, עקב מעבר מים כלפי חוץ, התייבשות קשה הגורמת לו להתקמט. למרבה המזל, באורגניזם האנושי התאים שקועים בפתרונות איזוטוניים ביחס לסביבתם הפנימית, וישנן מערכות שונות לשמירה על נוזלים אלה בשיווי משקל אוסמוטי.
לחץ אוסמוטי ואחסון מזון
בואו נחשוב רגע על ריבה תוצרת בית ... סוכר מתווסף בשפע לא רק כדי לשפר את טעמו, אלא גם ובעיקר להגדיל את חיי המדף שלו. ובכל זאת, סוכר הוא מרכיב חשוב בחייהם של מיקרואורגניזמים רבים המעורבים בפירוק המוצר. הסתירה לכאורה זו מפורקת מעצם מושג האוסמוזה.